
PROTEÇÃO DE GAIA E DO HOMEM

ACIDIFICAÇÃO DOS OCEANOS

A acidificação ameaça particularmente espécies dependentes de carbonato de cálcio (um composto químico que diminui à medida que o oceano se torna ácido), tais como recifes de corais, moluscos marinhos, e até mesmo plânton. Ao passo que estas espécies desaparecem, milhares de outras espécies dependentes estão propensas a seguir o mesmo caminho.
Um grave problema para a vida no planeta
A Assembleia Geral das Nações Unidas,ONU, prevê que, até 2050, a acidez dos oceanos poderá aumentar 150%, taxa cem vezes mais rápida que qualquer mudança na acidez do meio marinho ao longo dos últimos 20 milhões de anos.

Entende-se por acidificação a redução do pH dos oceanos por longos períodos de tempo (décadas ou mais).
O aumento contínuo das emissões antropogénicas de CO2 para a atmosfera desde o início da Revolução Industrial há 250 anos elevou a concentração de dióxido de carbono na atmosfera a níveis 40% superiores aos encontrados no período pré-industrial. Aproximadamente ¼ destas emissões anuais é absorvido pelos oceanos
O dióxido dissolvido na água reage com moléculas de água (H2O) e produz ácido carbónico (H2CO3) que, por ser instável, se dissocia libertando iões bicarbonato, e protões de hidrogénio (H+). Os iões bicarbonato, por sua vez, também se dissociam, libertando iões carbonato. Os iões bicarbonato, por sua vez, também se dissociam, libertando iões carbonato, e mais iões H+, sendo este último o responsável pela diminuição do pH do oceano.

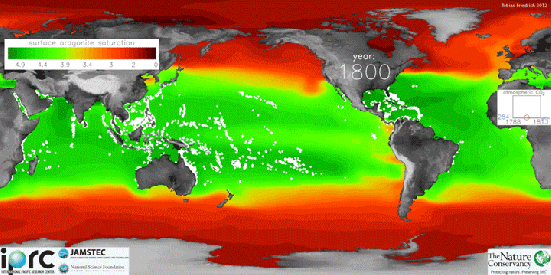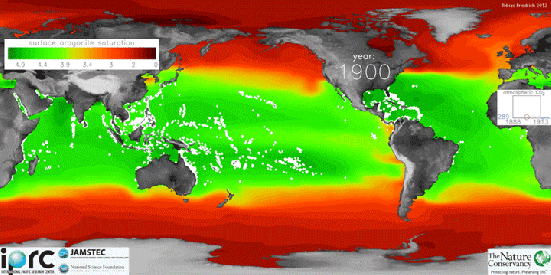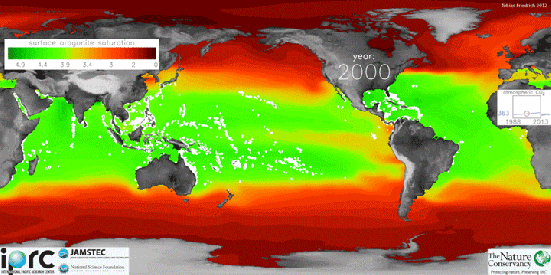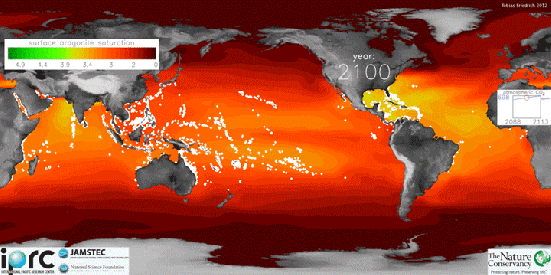
Usando medições por satélite, pesquisadores da Universidade de Exeter, no Reino Unido criaram mapas globais de acidez do oceano que mostram as áreas mais afetadas.
A parte mais vermelho é a mais ácida e a azul é a que possui menos acidez.
A QUÍMICA DA ACIDIFICAÇÃO
MEDIÇÃO DO pH DOS OCEANOS
CONSEQUÊNCIAS DA ACIDIFICAÇÃO

A reacção química (2) acontece para compensar o excesso de iões H+ na água do mar. O ião carbonato ([CO3]2-) que participa nesta reacção é “roubado” ao carbonato de cálcio, (CaCO3) dissolvido na água do mar, representado pela reacção química (3).
Assim quanto maior a quantidade de iões H+ no mar (ou seja quanto mais baixo for o valor de pH da água do mar), menor a quantidade de carbonato de cálcio disponível para a produção de conchas de moluscos (como por exemplo o mexilhão) e cefalópodes (como a lula e o choco), para a produção de carapaças de crustáceos (como o caranguejo e a lagosta) e para a produção de esqueletos de corais e esponjas.
As borboletas marinhas são pequenos moluscos muito importante na cadeia alimentar, servindo de alimento a animais como a baleia e o salmão. Quando colocadas em água com níveis de pH e de ião carbonato previstos para 2100, ao fim de 45 dias, a concha está seriamente deformada. Seria impossível o molusco sobreviver e, em consequência, todos os animais que dependem dele.

2016 - 2017



Para começar, seria preciso intensificar o uso de energias limpas, como a eólica e a solar, em substituição dos combustíveis fósseis.
Até mesmo o cidadão comum pode, e deve, colaborar. Banhos rápidos, aparelhos elétricos mais eficientes e a sua racionalização e, claro, opção pelos transportes coletivos, são medidas simples, mas que certamente produzirão um bom resultado se adotadas por bilhões de cidadãos conscientes de todo o planeta.Paralelamente, seriam necessárias políticas públicas que reduzissem a produção de CO2, sobretudo na atividade industrial.
